2·實驗原理和方法
2.1酸析法原理
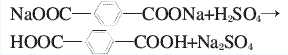
堿減量廢水中的對苯二甲酸鈉與硫酸作用形成對苯二甲酸。當廢液pH值<3時,對苯二甲酸幾乎不溶于水,因此會從堿減量廢水中析出。
2.2堿減量廢水水質分析
2.2.1 COD的測定
在強酸性溶液中,一定量的重鉻酸鉀氧化水樣中還原性物質,過量的重鉻酸鉀以試亞鐵靈作指示劑、用硫酸亞鐵銨溶液回滴。根據用量計算水樣中還原性物質的量。
2.2.2稀釋倍數法色度測定
將樣品用光學純水稀釋至用目視比較與光學純水相比剛好看不見顏色時的稀釋倍數作為表達顏色的強度,單位為倍。
2.2.3濁度測定
在25℃下,硫酸肼與六次甲基四胺聚合,形成白色高分子聚合物。以不同濃度的聚合物溶液作為濁度標準液,水樣濁度與其相比較而得。
2.2.4對苯二甲酸含量測定
對苯二甲酸溶于氫氧化鈉溶液,讀取分光光度計A254、A256值,求得(A254-A256)/2。前式的值與對苯二甲酸濃度在一定范圍內成直線關系,所以可按其測得的吸光度求出對苯二甲酸的含量。事實上,廢水中不含對苯二甲酸,而是以對苯二甲酸鈉形式存在。這里所謂的對苯二甲酸含量是指由對苯二甲酸鈉換算得到的相應值。
2.3對苯二甲酸特性分析
2.3.1酸值測定
取1g樣品,加入吡啶10mL,加熱溶解后冷卻至室溫,加入15mL H2O。以酚酞為指示劑,用0.5mol/LKOH標準溶液滴定。
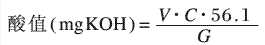
式中,V-KOH標準溶液用量,mL;C-KOH標準溶液濃度,mol/L;G-樣品重量,g。
2.3.2灰分測定
取2g樣品放入已恒重的20mL坩鍋中,在電爐上小心進行碳化。再于馬福爐中在800℃下灼燒至恒重。
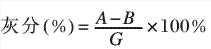
式中,A-樣品灼燒的重量,g;B-坩鍋重量,g;G-樣品重量,g。
2.4絮凝和脫色使用3種不同的有機高分子絮凝脫色劑(1#,2#,3#)。將稀釋20倍脫色劑加入1L廢水中,攪拌均勻后,靜置20min再進行過濾。
2.5酸析
取絮凝脫色后的堿減量廢水1L,分別緩慢加入濃硫酸并且不斷攪拌,直至pH為2。靜止片刻后,廢水進行過濾。濾液進行水質分析,而濾餅烘干并測定對苯二甲酸特性。
<<上一頁[1][2][3][4]下一頁>>
 相關信息
相關信息 






 推薦企業
推薦企業 推薦企業
推薦企業
 推薦企業
推薦企業